帝京大学臨床研究審査委員会へ新規臨床研究の審査を申請する場合の流れについて主に説明します。
研究代表医師または研究責任医師は、審査の申請前にARO(Academic Research Organization)等で研究計画やデザイン等の相談を受けた後に申請してください。申請前の相談を帝京大学臨床研究センター(TARC)で受ける場合は下記をご参照のうえご連絡ください。
申請の前に、利益相反関係の確認を行ってください。手順および使用書式は、本学委員会への申請と学外委員会への申請で共通です。
下記の書式を作成の上、以下4点を医学部臨床研究審査委員会事務局(大学棟本館2階板橋キャンパス事務部内)にご提出ください。
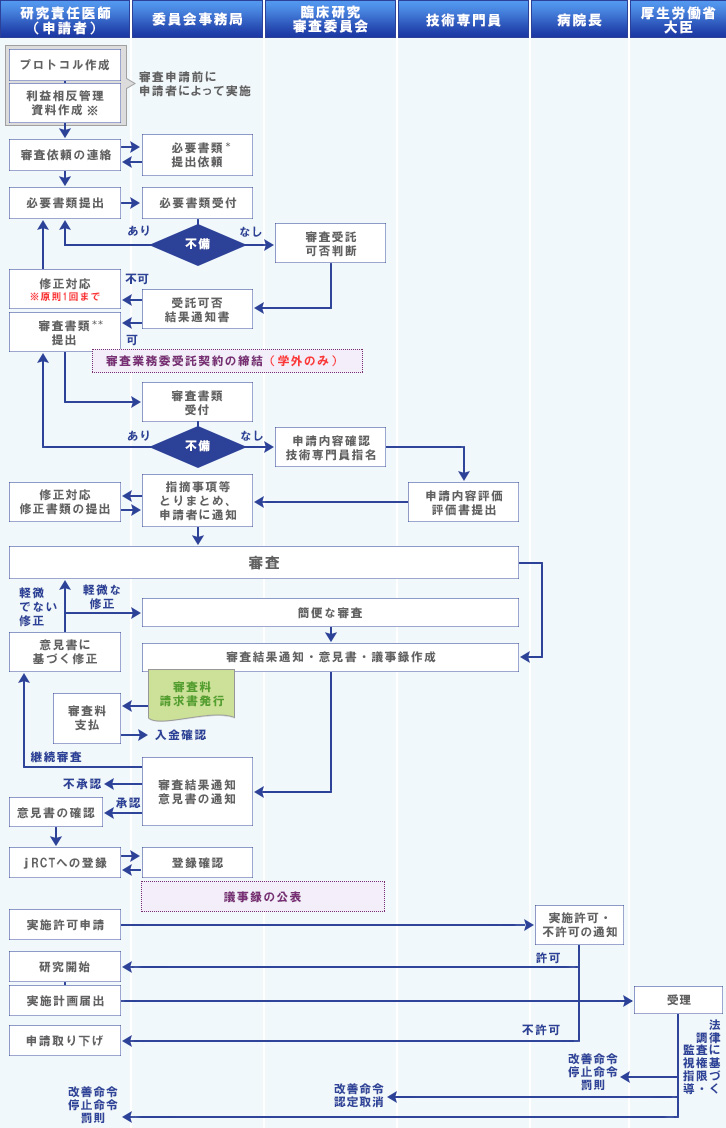
新規申請の際は、下記のフローに沿って審査が行われます。
書式名をクリックするとword様式が開きます。必要事項を記入のうえ、提出ください。
なお、各種申請書の書式等は更新される場合があります。常に最新版をダウンロードして使用ください。
| NO. | 書類 *新規申請フロー内の申請前確認の必要書類 **新規申請フロー内の審査申請時の審査書類 | 申請前 | 新規申請 | 変更申請 | 定期報告 | 不適合など | 疾病など | 中止 | 終了 | 備考 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 審査意見業務委託申請書* 帝臨委(書式1-1) 帝臨委(書式1-2)(学外) | 〇 | 書式1-1は資金源により書式が異なります。(ファイルには全書式あり) | |||||||
| 2 | 研究実施計画書* 帝臨委(書式2) | 〇 | 〇 | |||||||
| 3 | 同意説明文書* 帝臨委(書式3) | 〇 | 〇 | |||||||
| 4 | 同意書・同意撤回書* 帝臨委(書式4) | 〇 | 〇 | |||||||
| 5 | 利益相反関係報告資料(Ver.3.1)* 厚労省(様式A-E) | 〇 | 〇(必要に応じて) | ファイルには様式A〜Eが含まれているが、認定臨床研究審査委員会に提出が必要な様式はAとEのみ。
※多施設共同研究の場合は、研究代表医師が全実施医療機関分の様式Eを取りまとめて提出すること。 | ||||||
| 6 | 審査意見業務委受託契約書* 帝臨委(書式5) | 〇(学外のみ) | ||||||||
| 7 | 審査依頼書** 帝臨委(書式6) | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 | 〇 | ||
| 8 | 新規審査依頼書** 統一書式2 | 〇 | ||||||||
| 9 | 実施計画** 様式第一 | 〇 | 記載見本 | |||||||
| 10 | 研究分担医師リスト** 統一書式1 | 〇 | 多施設共同研究の場合は、研究代表医師が全実施医療機関分を取りまとめて提出すること。 | |||||||
| 11 | 疾病等が発生した場合の対応に関する手順書** (任意様式) | 〇 | 研究計画書に記載する場合は不要。 | |||||||
| 12 | モニタリングに関する手順書** (任意様式) | 〇 | 研究計画書に記載する場合は不要。 | |||||||
| 13 | 監査に関する手順書** (任意様式) | 〇 | 監査しない場合、および、監査する場合で研究計画書に記載する場合は不要。 | |||||||
| 14 | 統計解析計画書** (任意様式) | 〇 | 作成しない場合は不要。 | |||||||
| 15 | 医薬品等の概要を記載した書類** (任意様式) | 〇 | ある場合(例:既承認の医薬品/医療機器の場合添付文書等) | |||||||
| 16 | 症例報告書** (任意様式) | 〇 | ある場合(例:EDCは画面コピー等) | |||||||
| 17 | 実施医療機関の要件** 参考書式2-1 参考書式2-2 | 〇 | ||||||||
| 18 | 〇 | 研究(代表)責任医師/研究分担医師はそれぞれ該当する書式にて提出。 ※多施設共同研究の場合は、研究代表医師が全実施医療機関分を取りまとめて提出すること。 | ||||||||
| 19 | 教育・研修受講証明書** 各種修了証 | 〇 | 研究(代表)責任医師/研究分担医師は下記いずれかの受講・修了証を提出。 ・ICR Web(臨床研究の基礎知識) ・APRIN (旧CITI) ・上記相当の講座・セミナー等
※多施設共同研究の場合は、研究代表医師が全実施医療機関分を取りまとめて提出すること。 | |||||||
| 20 | 企業が関与する研究の場合はその契約状況等が確認できる書類** | 〇 | 医薬品等製造業者又はその特殊関係者との資金提供に関する契約書等。 | |||||||
| 21 | 被験者の健康被害の補償について説明した文書** | 〇 | 研究参加者への支払いがある場合は、それに関する資料。 (例:臨床研究保険証書等) | |||||||
| 22 | 被験者の募集の手順に関する資料** | 〇 | 研究参加者の募集に際し広告等を用いる場合は、その手順を記載した資料。 | |||||||
| 23 | 実施計画事項変更届書 様式第二 | 〇 | ||||||||
| 24 | 変更審査依頼書 統一書式3 | 〇 | ||||||||
| 25 | 実施計画事項軽微変更届書 様式第三 | 〇 | ||||||||
| 26 | 軽微変更通知書 統一書式14 | 〇 | ||||||||
| 27 | 定期報告書 別紙様式3 | 〇 | ||||||||
| 28 | 定期報告書 統一書式5 | 〇 | ||||||||
| 29 | 重大な不適合報告書 統一書式7 | 〇 | ||||||||
| 30 | 疾病等報告書 別紙様式2-1(医薬品) 別紙様式2-2(医療機器) | 〇 | 報告期限内に必要な宛先への報告を行ってください。詳細は「報告等について」のページを参照ください。 | |||||||
| 31 | 医薬品の疾病等報告書 統一書式8 医療機器の疾病等または不具合報告書 統一書式9 再生医療等製品の疾病等または不具合報告書 統一書式10 | 〇 | ||||||||
| 32 | 統一書式8~10の詳細記載用 詳細記載用書式 | 〇 | ||||||||
| 33 | 特定臨床研究中止届書 様式第四 | 〇 | ||||||||
| 34 | 中止通知書 統一書式11 | 〇 | ||||||||
| 35 | 終了届書 別紙様式1 | 〇 | ||||||||
| 36 | 終了通知書 統一書式12 | 〇 |
帝京大学板橋キャンパス事務部総務課内 医学部臨床研究審査委員会事務局
〒173-8606 東京都板橋区加賀2-11-1
平日 9:00~17:00 (土日、祝日、創立記念日(6/29)、年末年始を除く)